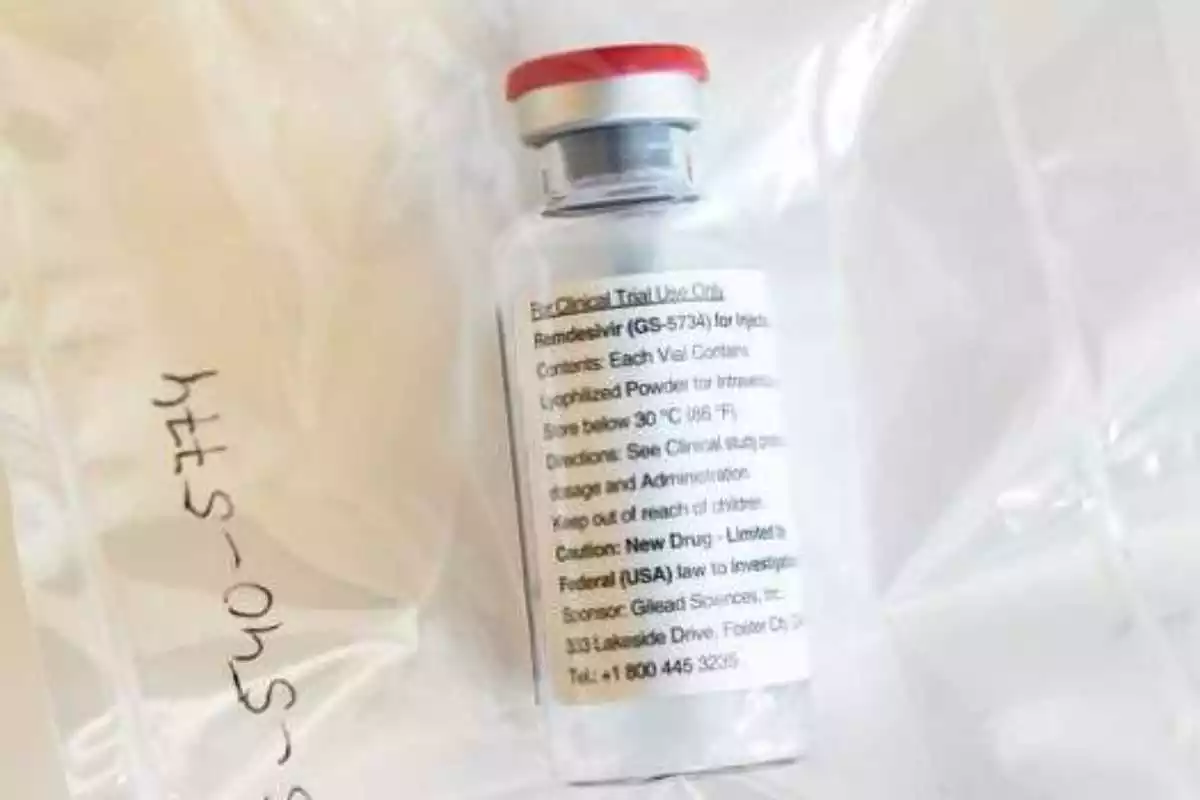
L'Agència Europea del Medicament (EMA) ha recomanat l'autorització per a la comercialització del remdesvir, un antiviral que evita que el coronavirus es repliqui en l'organisme. És el primer pas per a l'aparició del primer medicament per tractar pacients amb Covid-19 en estat greu.
En concret, aquest fàrmac està indicat per a adults i adolescents a partir de 12 anys amb pneumònia que requereixen oxigen suplementari. La recomanació de l'EMA es basa en els resultats preliminars de l'estudi més gran realitzat fins a la data amb aquest medicament, i que mostra una mitjana de recuperació de quatre dies abans que la resta de pacients.
És un nou pas per a la comercialització del primer fàrmac per tractar la Covid-19. Aquest medicament ja havia estat aprovat a principis de maig per la FDA, l'agència del medicament dels Estats Units, per la via d'emergència.
L'agència europea ha pres la decisió aquest dijous i permet que el medicament es pugui vendre a tota la Unió Europea. Això es podrà fer abans de comptar fins i tot amb totes les dades sobre eficàcia i efectes secundaris, si es constata que té més beneficis que riscos per al pacient.
La rapidesa de l'aprovació es deu al fet que l'EMA ja havia posat en marxa el passat 30 d'abril una anàlisi sobre l'ús d'aquest antiviral per al tractament específic de la Covid-19. Per a això va utilitzar un procediment de què disposa per accelerar l'avaluació de medicaments que siguin prometedors en cas d'emergència sanitària.
A Europa no s'havia aprovat encara cap fàrmac específic per a aquesta malaltia causada pel coronavirus. Els sanitaris empraven per tractar la malaltia tota classe de medicaments amb altres indicacions, com anticossos o dexametasona. Aquest és el primer antiviral específic per a la Covid-19, expliquen des dels serveis sanitaris.
El remdesivir només s'emprava en assajos clínics i per a casos molt extrems. A Espanya, l'agència del medicament només permetia l'ús excepcional des del 30 de març a gestants i nens, però a partir del 20 de maig va ampliar l'espectre a tots els hospitalitzats amb malaltia greu.
L'EMA va avaluar dades sobre qualitat i fabricació, i els resultats preliminars de diversos estudis des del passat 30 d'abril. Finalitzada la revisió, va convidar el fabricant, una empresa californiana, a enviar més informació a l'organisme europeu al costat d'una sol·licitud per a l'autorització de la comercialització.
Quant costarà el fàrmac
Un estudi preliminar realitzat amb 237 pacients a la Xina mostrava que el remdesivir no aportava beneficis. Però un altre estudi del 22 de maig demostrava la reducció de la mortalitat i el temps de recuperació. Un altre estudi posterior llançava un 68% de pacients recuperat amb el tractament d'aquest fàrmac.
El comitè de seguretat de l'EMA també va estudiar les mesures per identificar i minimitzar els efectes secundaris del fàrmac. El remdesivir ja havia estat investigat per a l'Ebola, però el rebrot va finalitzar abans de concloure l'assaig. I ja aleshores es va descobrir un efecte advers, la hipotensió. Per a pacients que requereixin medicació per a aquest cas, pot ser un risc.
Els experts coincideixen que la notícia és positiva i el remdesivir és un bon avanç, però adverteixen que no és la panacea. Segons expliquen, no és el tractament de la Covid-19, i necessitarà complements perquè el pacient es recuperi. També serà clau identificar el moment exacte per a l'administració del fàrmac.
Quan arribarà el fàrmac als hospitals? Queda un llarg camí per recórrer. L'aprovació de l'EMA és el primer pas, però ara les agències reguladores han de negociar i acordar un preu amb la farmacèutica. El càlcul és que costarà 4.000 euros per tractament.